Статья, подготовленная специалистами Тэсто Рус, отвечает на следующие, очень распространённые вопросы относительно процесса валидации:

На практике, валидация заключается в проверке способности определённого инженерного оборудования склада (системы вентиляции, холодильных агрегатов, и т.п.) выполнять свои функции так, чтобы поддерживать условия хранения в допустимых пределах.
Результатом валидационных мероприятий является документация, подтверждающая вышеизложенное.
 С переходом российской фармотрасли на стандарты производства GMP, валидация всех процессов, влияющих на качество, стала для фармпроизводителей необходимостью.
С переходом российской фармотрасли на стандарты производства GMP, валидация всех процессов, влияющих на качество, стала для фармпроизводителей необходимостью.
Несмотря на то, что GMP в России на законодательном уровне введено пока только для производителей, в Европе и Америке также существуют дополнительные нормы надлежащих практик, затрагивающие всю цепочку поставки от производителя до конечного потребителя (например, GDP/GSP – надлежащая практика дистрибьюции/хранения) а также иные процессы, прямо или косвенно оказывающие влияние на качество (GLP/GEP/GAMP – надлежащая лабораторная практика/проектирование/автоматизация).
Необходимо подчеркнуть, что все надлежащие практики нацелены не на исправление каких-либо негативных факторов, а на предотвращение их возникновения в принципе.
В целом, контроль за соблюдением норм GxP ложится на производителя. Иными словами, производителю желательно иметь подтверждение от всех контрагентов, занятых в цепочке поставок от заводского склада готовой продукции до точек реализации, в том, что они также придерживаются надлежащих практик. Это снижает риски негативного влияния на готовую продукцию. Конечно, с одной стороны они не могут обязывать дистрибьютора следовать тем или иным рекомендациям, но с другой стороны, они также вправе не заключать контракт с контрагентом, не следующим нормам GxP.
Базовым видом работ по валидации фармацевтического склада является температурное картирование (temperature mapping).
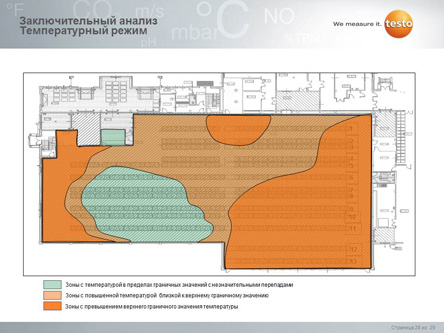 В результате этих мероприятий создается карта распределения температуры (в отдельных случаях и влажности) внутри объема склада/холодильных камер, выявляются зоны температурной неоднородности и определяются критические точки (например, самая холодная и самая горячая точки в зоне).
В результате этих мероприятий создается карта распределения температуры (в отдельных случаях и влажности) внутри объема склада/холодильных камер, выявляются зоны температурной неоднородности и определяются критические точки (например, самая холодная и самая горячая точки в зоне).
По результатам мэппинга можно сделать вывод о соответствии склада его назначению и принять корректирующие меры (после чего опять сделать мэппинг и подтвердить, что меры возымели эффект). Отдельно необходимо подчеркнуть, что мэппинг целесообразно проводить 1 раз в сезон (итого 4 раза в год), так как, в зависимости от сезона, могут изменяться зоны температурной неоднородности. В случае, если на складе были сделаны существенные изменения (например, установлены или модернизированы системы вентиляции/кондиционирования и отопления, перемещены стеллажи и т.д.) необходимо провести мэппинг повторно.
Также целесообразно один раз в определенный срок (например, раз в три года, при условии, что на складе не были сделаны существенные изменения) проводить контрольный мэппинг, подтверждающий, что условия хранения не изменились.
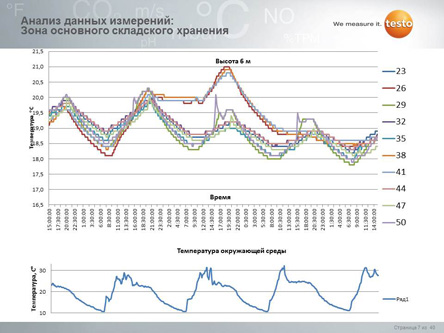 Расширенные работы по валидации могут включать в себя эмуляцию критических условий (например, вывод холодильных камер на критические режимы, открытие ворот в погрузочной зоне и т.д.). Это позволяет определить степень воздействия на продукцию в аварийных случаях и принять корректирующие меры для снижения вероятности возникновения таких случаев, либо снижения уровня негативного воздействия (например, установить бесперебойное питание камер). А также разработать комплекс мероприятий (SOP-стандартные операционные процедуры), следуя которым можно снизить негативное воздействие до приемлемого уровня.
Расширенные работы по валидации могут включать в себя эмуляцию критических условий (например, вывод холодильных камер на критические режимы, открытие ворот в погрузочной зоне и т.д.). Это позволяет определить степень воздействия на продукцию в аварийных случаях и принять корректирующие меры для снижения вероятности возникновения таких случаев, либо снижения уровня негативного воздействия (например, установить бесперебойное питание камер). А также разработать комплекс мероприятий (SOP-стандартные операционные процедуры), следуя которым можно снизить негативное воздействие до приемлемого уровня.
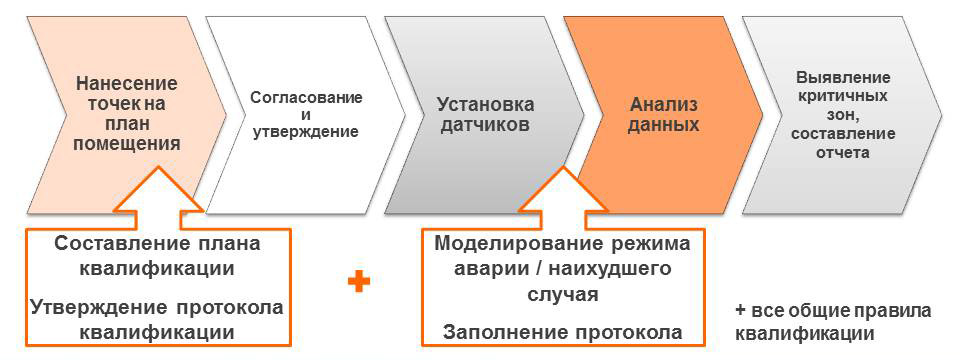
Однако валидацией дело обычно не заканчивается. Так, правилами GxP прямо предписано проводить регулярный мониторинг всех факторов, оказывающих влияние на качество. Таким образом, касательно режимов хранения необходимо проводить мониторинг и документирование параметров хранения (температура/влажность).
Лучшим решением этой проблемы являются автоматизированные системы мониторинга параметров микроклимата.
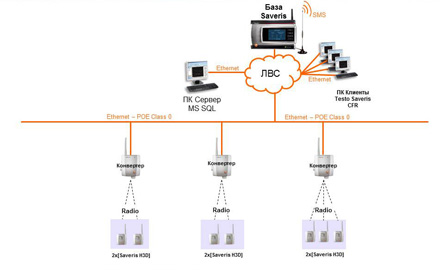 К подобным системам относится, широко используемая на многих предприятиях фармацевтического сектора система мониторинга температуры и влажности testo Saveris. Данная система разработана специально для применения в данной отрасли, соответствует требованиям GMP и может быть квалифицирована.
К подобным системам относится, широко используемая на многих предприятиях фармацевтического сектора система мониторинга температуры и влажности testo Saveris. Данная система разработана специально для применения в данной отрасли, соответствует требованиям GMP и может быть квалифицирована.
Важнейшим преимуществом использования testo Saveris является то, что измеренные значения собираются автоматически и защищены от потери или искажения в процессе обработки. Кроме того, нет необходимости загружать персонал измерениями и записью данных в журнал вручную, поскольку к подобной документации инспектора относятся крайне скептически из-за высокого влияния человеческого фактора на точность и достоверность данных.
 Также стоит отметить, что программное обеспечение Saveris CFR относится к категории 3 по GAMP5, что позволяет не проводить валидацию программных алгоритмов (в отличии от систем, базирующихся, например, на SCADA, в которых валидация программных алгоритмов, строго говоря, обязательна). Тем не менее, Testo провело независимую экспертизу ПО и компонентов системы Saveris в Фраунгоферовском институте программной инженерии, которая подтвердила их соответствие требованиям 21 CFR 11.
Также стоит отметить, что программное обеспечение Saveris CFR относится к категории 3 по GAMP5, что позволяет не проводить валидацию программных алгоритмов (в отличии от систем, базирующихся, например, на SCADA, в которых валидация программных алгоритмов, строго говоря, обязательна). Тем не менее, Testo провело независимую экспертизу ПО и компонентов системы Saveris в Фраунгоферовском институте программной инженерии, которая подтвердила их соответствие требованиям 21 CFR 11.
Хотя это и не отменяет необходимость проводить валидацию системы мониторинга (SAT/IQ/OQ/PQ), однако существенно снижает объем работ по валидации (валидация алгоритмов ПО – один из самых затратных разделов)
«Тэсто Рус» предлагает комплексный подход к приведению складского или производственного помещения в соответствие с GMP в части вопросов, касающихся валидации и мониторинга климатического режима хранения – от квалификации отдельного холодильника до валидации условий хранения с последующим внедрением и валидацией системы мониторинга.
Данной возможностью уже воспользовались многие ведущие фармацевтические дистрибьюторы и производители, такие как Santens Logistic group, NC Pharm, FM Logistic, Радуга Продакшн, Serdix (группа Servier), PPD и другие (список реализованных проектов можно посмотреть по ссылке: http://climatecontrolsolutions.ru/testo-saveris-reference-list.html)
Новости
|
||||||||||||||||||||||||||
 |
Вебинар: Комплексные решения Testo для фармацевтической отрасли Приглашаем принять участие в предствоящем вебинаре "Комплексные решения Testo для фармацевтической отрасли". |
 |
Вебинар: Логгеры-регистраторы параметров микроклимата в фармацевтической отрасли Приглашаем принять участие в предствоящем вебинаре "Логгеры-регистраторы параметров микроклимата в фармацевтической отрасли". |
 |
Вебинар: Измерительные приборы Testo для фармацевтической отрасли В ближайший четверг, 18 ноября приглашаем вас на бесплатный вебинар «Измерительные приборы Testo для фармацевтической отрасли». |
|
22 мар |
Мировой уровень покрытия GMP составляет порядка 60%
|
|---|
|
19 фев |
Эксперт: Маркировка лекарств может обойтись среднему предприятию в 6 млн евро
|
|---|
|
12 окт |
Сергей Цыб о проверках и повышении качества российских лекарств
|
|---|
|
31 авг |
Разработан проект Руководства по обеспечению целостности данных
|
|---|
|
18 май |
Правила GDP. Квалификация транспортных средств
|
|---|